Реферат На Тему Идеальный Газ
Идеальный газ 2. Оглавление. Введение. 2. Уравнение состояния идеального газа. Закон Бойля- Мариотта. Закон Гей- Люссака. Закон Шарля. 3. Заключение.
Xreferat.com » Рефераты по математике » Идеальный газ. Под идеальным газом будем понимать газ, между частицами которого взаимодействие настолько мало, что им можно пренебречь. Тема: Идеальный газ. Вид работы: Доклад. Под идеальным газом будем понимать газ, между частицами которого взаимодействие настолько мало, что им можно пренебречь. Идеальный газ с точки зрения молекулярно-кинетической теории простейшая физическая модель реального газа. Под моделью в физике понимают не.
Список источников. Введение. Идеальный газ — математическая модельгаза, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван- дер- Ваальса, в котором учитывается притяжение между молекулами.

Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна). Газовые законы - законы термодинамических процессов, протекающих в системе с неизменным количеством вещества при постоянном значении одного из параметров: закон Шарля, закон Гей- Люссака, закон Бойля- Мариотта, а также закон Авогадро, закон Дальтона.
- Идеальный газ — математическая модель газа, в которой в рамках молекулярно-кинетической теории предполагается, что: потенциальной энергией .
- Уравнение состояния газа Ван-дер-Ваальса, его сущность и краткая. Изотермы реального газа и правило фаз Максвелла. Физика, реферат. Другие документы, подобные "Законы идеальных газов".
- Идеальный газРаспределение Больцмана. Под идеальным газомбудем понимать газ, между частицами которого взаимодействие настолько мало, чтоим можно пренебречь. Это предположение может быть обеспечено малостьювзаимодействия частиц при любых.
- Молекулярно-кинетическая теория газа. Основные газовые законы для идеальных газов. Список литературы. Еще 200 лет.
- Доклады, рефераты, лекции, конспекты, шпаргалки. Маунтин-Вью познакомиться с холостым Подробнее. Тема : Для описания состояния идеального газаданной массы достаточно трех Укажем, что при переходе идеального газа из состояния 1 в состояние 2 масса газа оставалась неизменной.
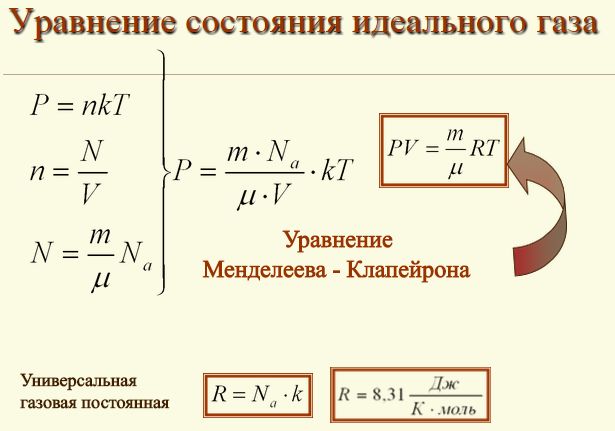
Уравнение состоянияидеального газа. Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона ) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: где . Семилетняя Война Презентация 10 Класс на этой странице. Так как , где где . Уравнение можно записать в виде: Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей- Люссака: — закон Бойля — Мариотта. Изотерма. ЗАКОН БОЙЛЯ — МАРИОТТА, один из основных газовых законов, который описывает изотермические процессы в идеальных газах.
Его установили учёные Р. Бойль в 1. 66. 2 г. Мариотт в 1. 67. 6 г. Согласно закону Бойля- Мариотта при постоянной температуре Т объем V данной массы m идеального газа обратно пропорционален его давлению р, т. Другими словами: произведение объема данной массы идеального газа на его давление постоянно при постоянной температуре. Закон Бойля — Мариотта выполняется строго для идеального газа. Для реальных газов закон Бойля — Мариотта выполняется приближенно.
Идеальный газ - это физическая модель газа, взаимодействие между молекулами. Дополнительные расчетные формулы по теме. Идеальный газ – это модель разреженного газа, в которой пренебрегается взаимодействием между молекулами. Силы взаимодействия между.
Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах. Закон Бойля — Мариотта следует из кинетической теории газов, когда принимается допущение, что размеры молекул пренебрежимо малы по сравнению с расстоянием между ними и отсутствует межмолекулярное взаимодействие. При больших давлениях необходимо вводить поправки на силы притяжения между молекулами и на объем самих молекул. Как и уравнение Клайперона, закон Бойля — Мариотта описывает предельный случай поведения реального газа, более точно описываемый уравнением Ван- дер- Ваальса.
Применение закона приближенно можно наблюдать в процессе сжатия воздуха компрессором или в результате расширения газа под поршнем насоса при откачке его из сосуда. Термодинамический процесс, котроый происходит при постоянной температуре называется изотермическим. Изображение его на графике называется изотермой.(см. Изобара. Французский ученый Ж. Гей- Люссак в 1. 80. Данные лежат в основе газового закона Гей- Люссака. Формулировка закона Гей- Люссака следующая: для данной массы газа отношение объема газа к его температуре постоянно, если давление газа не меняется.
Эту зависимость математически записывают так: V/Т=const, если P=const и m=const. Применение: Данный закон приближенно можно наблюдать, когда происходит расширение газа при его нагревании в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня. Другим проявлением закона Гей- Люссака в действии является аэростат. Закон Гей- Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Закон справедлив для идеального газа. Он неплохо выполняется для разреженных газов, которые по своим свойствам близки к идеальному. Температура газа должна быть достаточно велика. Графически эта зависимость в координатах V- T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
От греческого слова «барос» - вес (тяжесть). Изохора. Французский ученый Ж. Шарль в 1. 78. 7 году нашел экспериментально зависимость давления газа от температуры при постоянном объеме. Данные лежат в основе газового закона Шарля. Формулировка закона Шарля следующая: для данной массы газа отношение давления газа к его температуре постоянно, если объем газа не меняется. Эту зависимость математически записывают так: P/Т=const, если V=const и m=const. Применение: Данный закон приближенно можно наблюдать, когда происходит увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
Изохорный процесс используется в газовых термометрах постоянного объема. Закон Шарля не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов. Закон справедлив для идеального газа. Он неплохо выполняется для разреженных газов, которые по своим свойствам близки к идеальному. Температура газа должна быть достаточно высокой.
Процесс должен проходить очень медленно Графически эта зависимость в координатах P- T изображается в виде прямой, выходящей из точки Т=0. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. От греческого слова «хорема»- вместимость. Список источников.
М: Машиностроение, 1. Курс физики. М: Высшая школа, 1.
В., Физика: Оптика. Тепловые явления. Строение и свойства вещества: Учебник для 1. Москва, «Просвещение», 2. Молекулярная физика и термодинамика - 2e изд., MФТИ, 2.
Я., Буховцев Б. Б., Сотский Н. Н., Физика, учебник для 1. Москва, «Просвещение», 2. И., Учебное пособие для изучающих физику в средней школе., Тамбов, ТИПКРО, Тамбовский областной физико- математический лицей, 1.